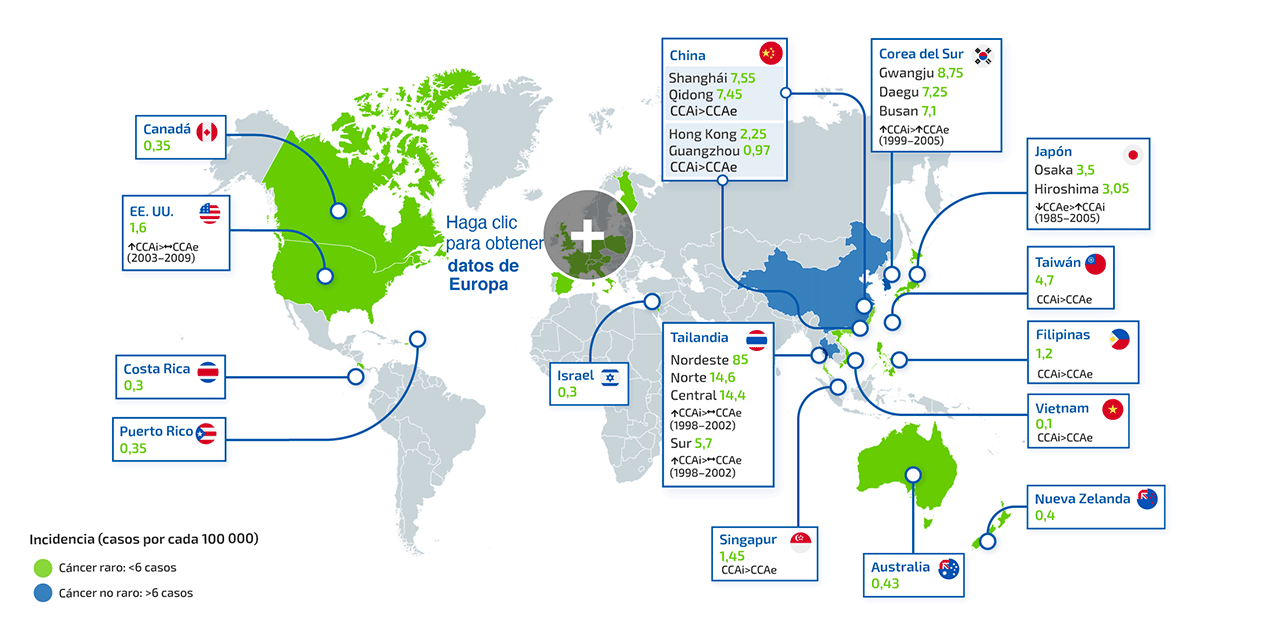
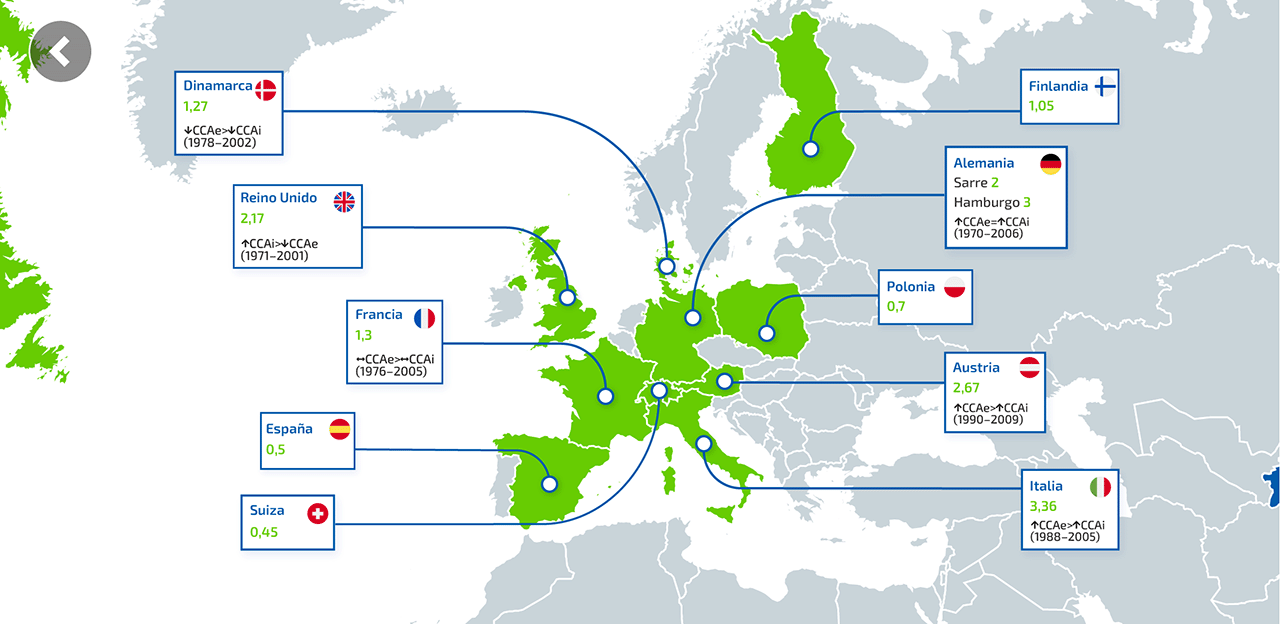
¿Qué es el colangiocarcinoma intrahepático (CCAi)?
El CCAi es un subtipo del colangiocarcinoma (CCA)
El CCA es la neoplasia maligna primaria más frecuente del conducto biliar y se clasifica por origen anatómico en el CCAi y CCA extrahepático (CCAe). El CCAe se divide en 2 tipos:1-3
- El CCA perihiliar (CCAp) (también denominado “tumor de Klatskin”) es la forma más frecuente,
representando el
50-70 % de todos los casos de CCA1,3 - El CCA distal (CCAd) representa el 30-40 % del total de casos de CCA1,3
El CCAi se origina en los conductos biliares dentro del hígado y representa <10 % de los casos de CCA1,3
El CCA se clasifica por origen anatómico3,4
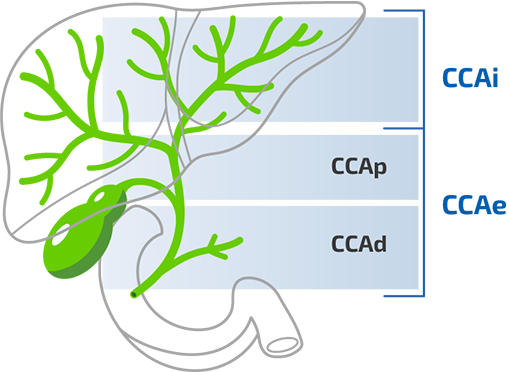
CCA, colangiocarcinoma; CCAd, colangiocarcinoma distal; CCAe, colangiocarcinoma extrahepático; CCAi, colangiocarcinoma intrahepático, CCAp, colangiocarcinoma perihiliar.
Figura adaptada de Blechacz B. 2017.4