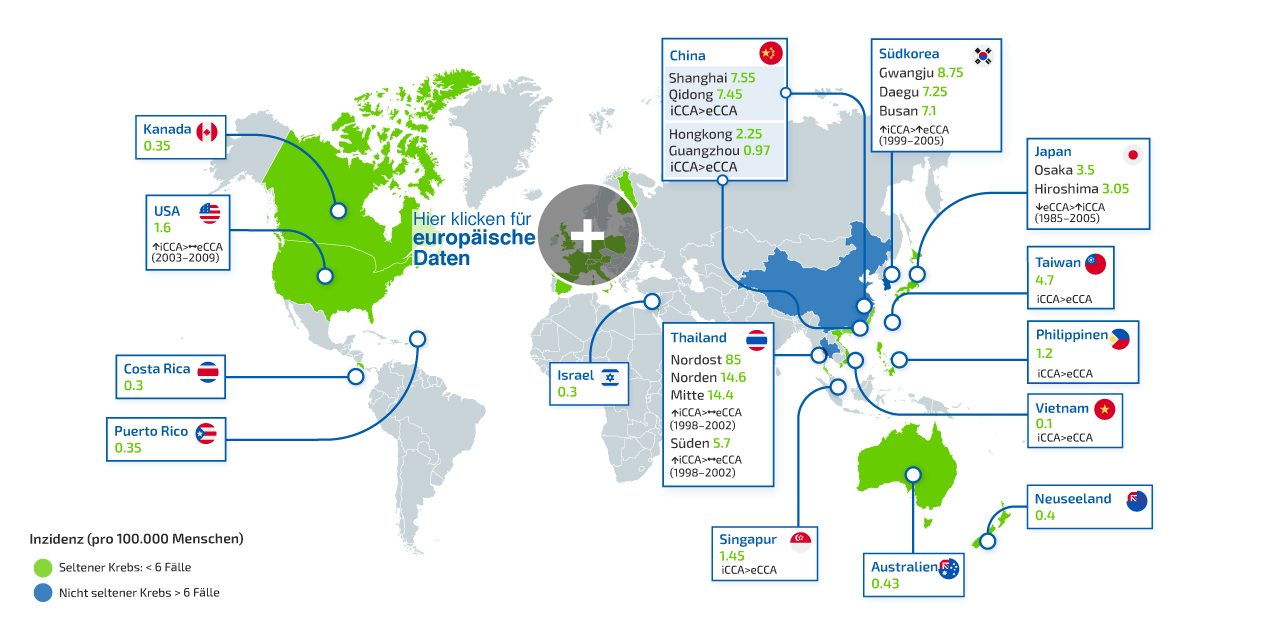
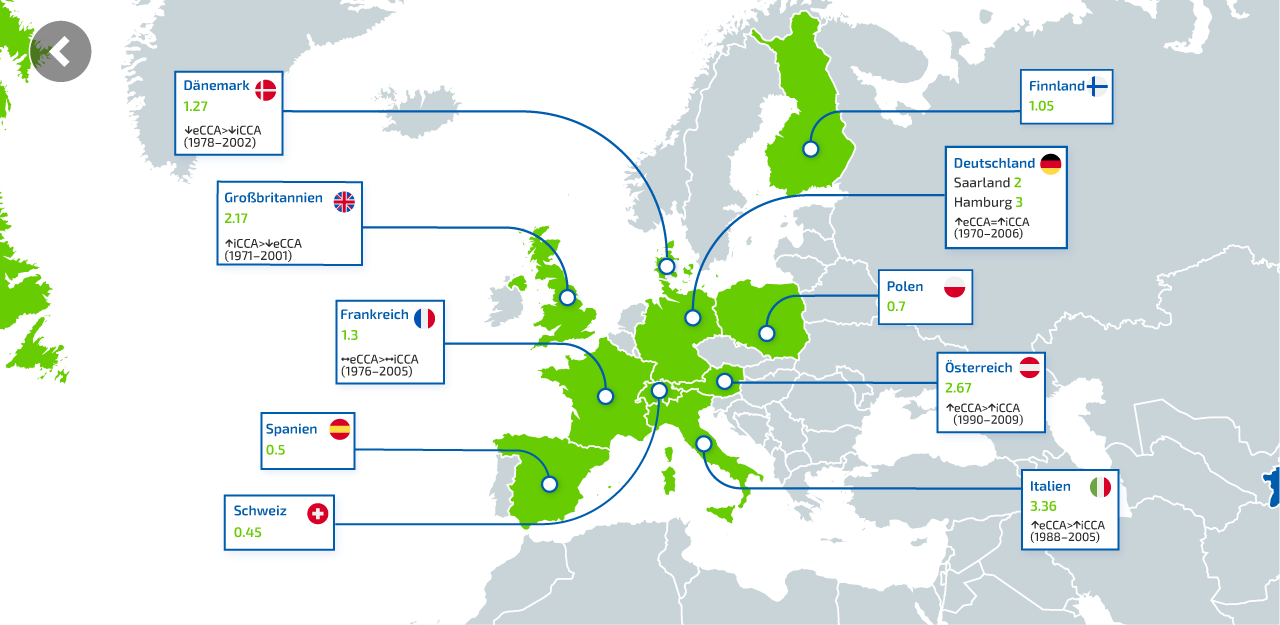
Was ist ein intrahepatisches Cholangiokarzinom (iCCA)?
iCCA ist ein Subtyp des Cholangiokarzinoms (CCA, auch Gallengangskarzinom)
CCA, die häufigste primäre Malignität des Gallenganges, wird nach seinem anatomischen Ursprung in iCCA und extrahepatische CCA (eCCA) klassifiziert.
eCCA wird in zwei weitere Typen unterteilt:1-3
- perihiläres CCA (pCCA) (auch „Klatskin-Tumor“ genannt) ist mit 50 – 70 % die häufigste Form aller CCA-Fälle1,3
- distales CCA (dCCA) macht 30 - 40 % der gesamten CCA-Fälle aus1,3
iCCAs haben ihren Ursprung in den Gallengängen in der Leber und macht <10 % der CCA-Fälle aus.1
Das Cholagiokarzinom wird nach dem anatomischem Ursprung klassifiziert:3,4
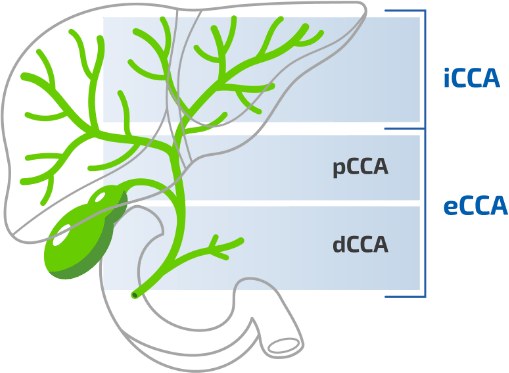
CCA, Cholangiokarzinom; dCCA, distales Cholangiokarzinom; eCCA, extrahepatisches Cholangiokarzinom; iCCA, intrahepatisches Cholangiokarzinom; pCCA, perihiläres Cholangiokarzinom.